L'emoglobina (Hb) è una metalloproteina contenente ferro presente in abbondanza nei globuli rossi di praticamente tutti i vertebrati. È spesso definita la "molecola che sostiene la vita" per il suo ruolo indispensabile nella respirazione. Questa complessa proteina è responsabile del compito fondamentale di trasportare l'ossigeno dai polmoni a tutti i tessuti del corpo e di facilitare il ritorno dell'anidride carbonica per l'escrezione. Comprendere la sua funzione, gli eleganti meccanismi che ne governano il comportamento e l'importanza fondamentale della sua misurazione clinica offre una finestra sulla salute e le malattie umane.
Funzione e meccanismo: un capolavoro di ingegneria molecolare
La funzione primaria dell'emoglobina è il trasporto dei gas. Tuttavia, non svolge questo compito come una semplice spugna passiva. La sua efficienza deriva da una sofisticata progettazione strutturale e da meccanismi di regolazione dinamici.
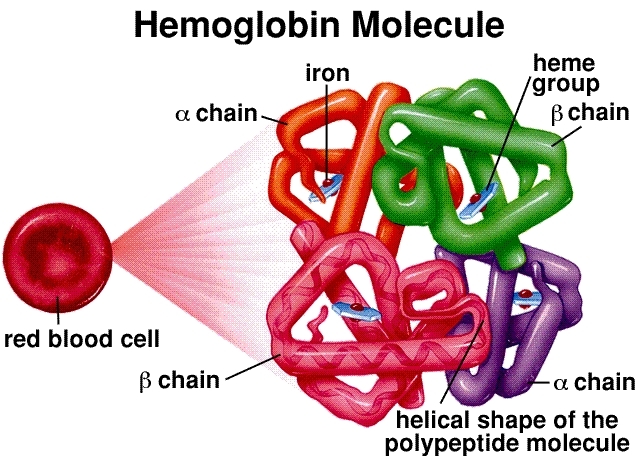
Struttura molecolare: l'emoglobina è un tetramero, composto da quattro catene proteiche globiniche (due alfa e due beta negli adulti). Ogni catena è associata a un gruppo eme, una complessa struttura ad anello con un atomo di ferro centrale (Fe²⁺). Questo atomo di ferro è il sito di legame effettivo per una molecola di ossigeno (O₂). Una singola molecola di emoglobina può quindi trasportare un massimo di quattro molecole di ossigeno.
Legame cooperativo e curva sigmoidale: questo è il fondamento dell'efficienza dell'emoglobina. Quando la prima molecola di ossigeno si lega a un gruppo eme nei polmoni (dove la concentrazione di ossigeno è elevata), induce un cambiamento conformazionale nell'intera struttura dell'emoglobina. Questo cambiamento facilita il legame delle due molecole di ossigeno successive. L'ultima quarta molecola di ossigeno si lega con la massima facilità. Questa interazione "cooperativa" determina la caratteristica curva di dissociazione dell'ossigeno sigmoidale (a forma di S). Questa forma a S è cruciale: significa che nell'ambiente ricco di ossigeno dei polmoni, l'emoglobina si satura rapidamente, ma nei tessuti poveri di ossigeno, può rilasciare una grande quantità di ossigeno con solo una piccola caduta di pressione.
Regolazione allosterica: l'affinità dell'emoglobina per l'ossigeno non è fissa; è finemente regolata dalle esigenze metaboliche dei tessuti. Ciò si ottiene attraverso effettori allosterici:
Effetto Bohr: nei tessuti attivi, un'elevata attività metabolica produce anidride carbonica (CO₂) e acido (ioni H⁺). L'emoglobina percepisce questo ambiente chimico e risponde diminuendo la sua affinità per l'ossigeno, stimolando un rilascio più generoso di O₂ esattamente dove è più necessario.
2,3-bisfosfoglicerato (2,3-BPG): questo composto, prodotto nei globuli rossi, si lega all'emoglobina e ne stabilizza lo stato deossigenato, favorendo ulteriormente il rilascio di ossigeno. I livelli di 2,3-BPG aumentano in condizioni di ipossia cronica, come ad alta quota, per migliorare l'apporto di ossigeno.
Trasporto di anidride carbonica: l'emoglobina svolge anche un ruolo fondamentale nel trasporto di CO₂. Una piccola ma significativa porzione di CO₂ si lega direttamente alle catene globiniche, formando carbaminoemoglobina. Inoltre, tamponando gli ioni H⁺, l'emoglobina facilita il trasporto della maggior parte della CO₂ sotto forma di bicarbonato (HCO₃⁻) nel plasma.
L'importanza critica del test dell'emoglobina
Dato il ruolo centrale dell'emoglobina, misurarne la concentrazione e valutarne la qualità è un pilastro fondamentale della medicina moderna. Il test dell'emoglobina, spesso parte di un emocromo completo (CBC), è uno degli esami clinici più comunemente richiesti. La sua importanza non può essere sopravvalutata per i seguenti motivi:
Monitoraggio della progressione della malattia e del trattamento:
Per i pazienti a cui è stata diagnosticata l'anemia, le misurazioni seriali dell'emoglobina sono essenziali per monitorare l'efficacia del trattamento, come l'integrazione di ferro, e per seguire la progressione di malattie croniche sottostanti come l'insufficienza renale o il cancro.
Rilevazione delle emoglobinopatie:
Test specializzati dell'emoglobina, come l'elettroforesi dell'emoglobina, vengono utilizzati per diagnosticare malattie genetiche ereditarie che colpiscono la struttura o la produzione dell'emoglobina. Gli esempi più comuni sono l'anemia falciforme (causata da una variante difettosa dell'HbS) e la talassemia. La diagnosi precoce è fondamentale per la gestione e la consulenza genetica.
Valutazione della policitemia:
Un livello di emoglobina anormalmente alto può indicare policitemia, una condizione in cui l'organismo produce troppi globuli rossi. Può trattarsi di un disturbo primario del midollo osseo o di una risposta secondaria all'ipossia cronica (ad esempio, in caso di malattie polmonari o in alta quota) e comporta un rischio di trombosi.
Screening e valutazione della salute generale: il test dell'emoglobina è un esame di routine durante le cure prenatali, i controlli pre-operatori e gli esami di benessere generale. Costituisce un indicatore generale dello stato di salute e nutrizionale.
Gestione del diabete: sebbene non si tratti dell'emoglobina standard, il test dell'emoglobina glicata (HbA1c) misura la quantità di glucosio che si è legato all'emoglobina. Riflette i livelli medi di glicemia degli ultimi 2-3 mesi ed è il gold standard per il controllo glicemico a lungo termine nei pazienti diabetici.
Conclusione
L'emoglobina è molto più di un semplice trasportatore di ossigeno. È una macchina molecolare dal design raffinato, che sfrutta il legame cooperativo e la regolazione allosterica per ottimizzare l'apporto di ossigeno in risposta alle esigenze dinamiche dell'organismo. Di conseguenza, la misurazione clinica dell'emoglobina non è solo un numero su un referto di laboratorio; è un potente strumento diagnostico e di monitoraggio non invasivo. Fornisce un'istantanea indispensabile della salute ematologica e generale di una persona, consentendo la diagnosi di condizioni che alterano la vita, il monitoraggio delle malattie croniche e la salvaguardia della salute pubblica. Comprendere sia il suo genio biologico che il suo significato clinico sottolinea perché questa umile proteina rimanga una pietra miliare della scienza fisiologica e medica.
Data di pubblicazione: 17-10-2025